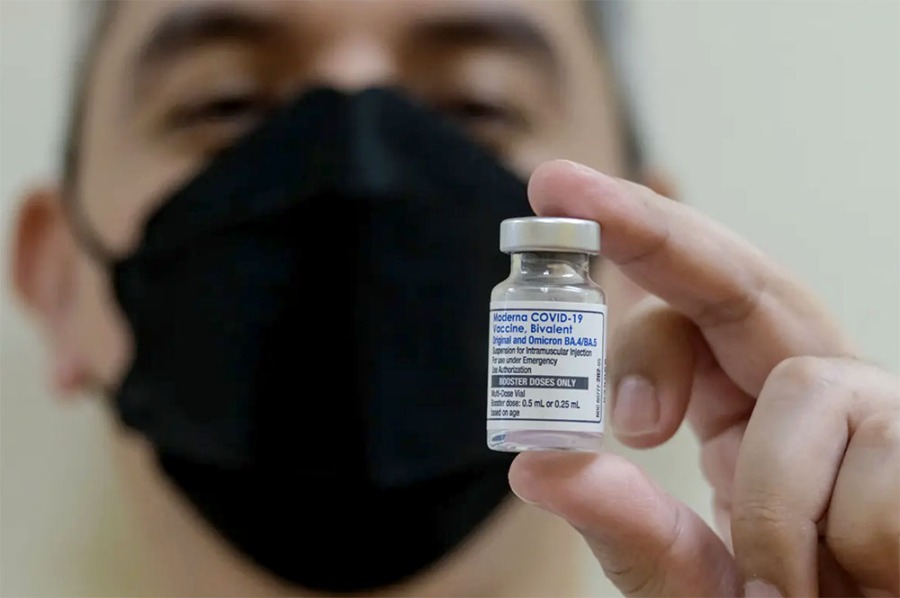
Министерство здравоохранения Канады опубликовало разрешение на новую прививку, сообщив, что вакцина нацелена на субвариант омикрон XBB.1.5.
Рекомендуются следующие прививки: одна доза для возраста от пяти лет и старше, а также в качестве бустера для возраста от шести лет и старше.
Для детей в возрасте от шести месяцев до четырех лет предлагается сделать две дозы, если они ранее не получали прививку COVID.
banner
12 сентября представители Министерства здравоохранения Канады провели технический брифинг по новой вакцине Moderna. Пресс-секретарь сказала, что вакцина была разрешена "после независимой и тщательной научной проверки на безопасность, эффективность и качество, включая анализ данных нескольких исследований первичной серии и бустерных доз вакцины VX, собранных за последние два года".
"Оценив все данные, мы пришли к выводу, что существуют убедительные доказательства того, что преимущества этой вакцины перевешивают потенциальные риски”.
Moderna заявила, что предварительные данные клинических испытаний "подтверждают, что обновлённая вакцина вызывает надёжный иммунный ответ у людей".
Побочные эффекты
Moderna заявила, что вакцину не следует вводить людям с известной историей тяжелой аллергической реакции на любой компонент, входящий в состав ее вакцины.
"Постмаркетинговые данные свидетельствуют о повышенном риске развития миокардита и перикардита, особенно в течение 7 дней после введения второй дозы первичной серии или первой бустерной дозы". В 72-страничном информационном листке перечислены предупреждения и меры предосторожности. Наибольший риск развития миокардита и перикардита, как отмечается в документе, наблюдается у мужчин в возрасте от 18 до 24 лет.
Компания заявила, что "пока нет информации о возможных долгосрочных" последствиях. Там же говорится: "Вакцины могут защитить не всех прививаемых".
Неблагоприятные реакции на вакцину, перечисленные Moderna для возраста от шести до 36 месяцев, включают: "эритема, боль и припухлость в месте инъекции; припухлость/нежность в подмышечной впадине (или паху), лихорадка, раздражительность/плаксивость, потеря аппетита и сонливость".
В возрасте 37 месяцев и старше побочные реакции включают все вышеперечисленное, а также "артралгию, озноб, усталость, головную боль, миалгию, тошноту/рвоту и сыпь".
Министерство здравоохранения Канады заявило, что оно активно рассматривает заявки от компаний Pfizer Biotech и Novavax, которые хотят получить разрешение на применение двух новых версий вакцин COVID.
banner
Рекомендации NACI
Национальный консультативный комитет по иммунизации (National Advisory Committee on Immunization, NACI) осенью 2023 года обновил своё руководство по использованию вакцин COVID, заявив, что по-прежнему рекомендует тем, кто уже получил вакцину COVID, получить одну дозу состава XBB.1.5, если прошло шесть месяцев после предыдущей прививки или известной инфекции.
NACI по-прежнему рекомендует вакцину взрослым 65 лет и старше, жителям домов длительного пребывания, лицам с хроническими заболеваниями, беременным женщинам, представителям коренных народов, "расово ориентированным и другим сообществам, заслуживающим справедливости", а также тем, кто оказывает "важные общественные услуги".
banner
NACI утверждает, что в Канаде циркулируют варианты COVID, причём наиболее распространённым является вариант под названием XBB.1.9.2.
"Ожидается, что люди, привитые обновлённой вакциной COVID-19, содержащей XBB.1.5, получат лучший иммунный ответ против циркулирующих в настоящее время штаммов по сравнению с более ранними формулами. Предварительные клинические данные продемонстрировали, что бустерная доза моновалентной XBB.1.5-содержащей вакцины COVID-19 вызвала аналогичный иммунный ответ против штаммов XBB* – XBB.1.5, XBB.1.16 и XBB.2.3.2".
NACI отметила, что пока не определено, должна ли существовать "ежегодная программа вакцинации COVID-19", аналогичная ежегодным прививкам от гриппа.
Управление по контролю за продуктами и лекарствами США (FDA) также одобрило новые вакцины COVID-19, включая вакцину от компаний Moderna и Pfizer. FDA одобрило эти вакцины для людей в возрасте от 12 лет и старше. Регуляторы выдали экстренное разрешение на применение этих прививок для людей в возрасте от 6 месяцев до 11 лет.
 9°C Монреаль
9°C Монреаль